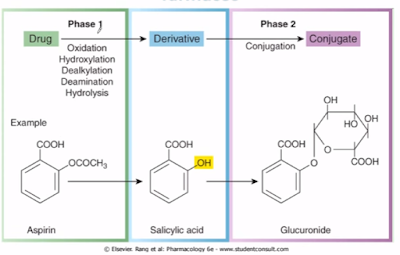
Farmacocinética vem do grego, fármaco(droga) cinética(movel), estuda o caminho percorrido pelo fármaco no organismo animal, ou seja, estuda o movimento de uma substância química, em particular, um fármaco no interior de um organismo vivo.
Processos Farmacocinéticos
São os processos que ocorrem durante todo o caminho percorrido pelo fármaco da sua absorção até a excreção e estão divididos em 4 etapas: Absorção, Distribuição, Biotransformação e Excreção.

A primeira fase é a administração, que pode ser por via oral. É a fase biofarmacêuitoca, ou eja, é a liberação da substância na sua forma terapêutica. No caso do comprimido é a dissolução deste fármaco. A partir daí ele será dissolvido e absorvido, e enviado ao compartimento central, ou seja, corrente sanguínea. A partir daí ele está em sua forma livre e logo depois é ligado as proteínas plasmáticas. Para chegar a seu local de ação, que pode ser u receptor ou enzima, ele irá se desligar da proteína e se ligar ao receptor, por exemplo. Pode ser ligado aos reservatórios teciduais. Alguns, são liposoluveis e podem ser ligar ao tecido adiposo, por exemplo, e parte dele vai sendo liberado aos poucos. Outros locais inesperados podem existir também, porém, nesse aso, alguns efeitos indesejados podem surgir. Após isso ocorre a excreção, passando pelo fígado, por exemplo e surgindo uma outra substância inativa e excretada pela urina.
Absorção
É a transferência de um fármaco desde seu local de administração até a circulação sanguínea. A velocidade e a eficiência da absorção vai depender entre outros fatores da via de administração.
A primeira barreira na absorção é a membrana celular dos enterócitos, que é a camada superficial do intestino delgado e intestino grosso. A primeira camada desta membrana é hidrofílica e a segunda hidrofóbica, Esta camada apresenta também fluidez, apresentam proteínas e muitas delas são alvo dos fármacos, muitas delas são receptoras de membranas para fármacos que produzem efeitos internamente mas agem se ligando a proteínas da bicamada lipídica. Relativamente impermeável às moléculas polares, porém as apolares se dissolvem na camada, tendo maior facilidade na entrada.
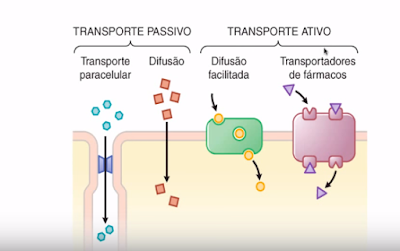
Existem diversos mecanismos de absorção e transporte para atravessar a barreira celular:
Transporte Passivo é o tipo de transporte onde não há gasto energético:
Transporte Paracelular: Onde o fármaco atravessa o espaço entre as células.
Transporte por Difusão Simples:
Atravessa a bicamada lipídica naturalmente por apresentar a característica de ser lipossolúveis. Nos casos dos anestésicos em geral.
Difusão por poros: Acontece com os fármacos hidrosolúveis mas apresentam baixo peso molecular, e por serem pequenos, passam pelos poros entre as células.
Transporte Ativo: é o tipo de transporte onde há gasto energetico, do meio extra para o intra contra um graiente de concentração, ou seja, existe uma barreira fisico quimica para que regula o transporte.
Difusão Facilitada: Precisa de proteínas que se ligam à molécula e carregam p dentro da célula, transportadoa favor de um gradiente de concenração.
Transportadores de Fármaco: Mesmo sendo para o lado menos concentrado, ele será transportado e gastará energia
Outro fator que interfere também na absroção de determinado fármaco é seu peso molecular, onde fármacos com peso molecular baixo, tem uma maior propensão a atravessar a membrana plasmática, como mostra o gráfico abaixo:
Dentre os fármacos com mesmo peso, o que diferencia a capacidade de permeabilidade depende do coeficiente de partição óleo/água ou octano/água.
Apesar disso, a maioria dos são ácidos fracos ou bases fracas, consequentemente tem a capacidade de se ionizar. Esta molécula tem a capacidade de se ionizar. As formas moleculares inteiras são estruturas mais lipossolúveis que hidrossolúvel e quando esta em sua forma normal, tem a capacidade de atravessar as membranas como um fármaco lipossolúvel, já se estiver em sua forma ionizada, ela não tem a capacidade de atravessar a membrana porque está na forma hidrossolúvel.
Se, por exemplo, um ácido fraco apresenta um pKa=4,4, ou seja, se o fármaco estiver em um Ph de 4,4 , aproximadamente 50% estará na sua forma ionizada e 50% na forma não-ionizada. Se ele for colocado, por exemplo, no suco gástrico, que apresenta uma concentração de ácidos muito grande, um Ph de 1,4, esse ácido se junta ao ácido do fármaco e desloca o equilíbrio do fármaco em direção a formação da estrutura molecular, ou seja, se aumentar a concentração de ácido, o equilibro é deslocado na formação da forma molecular mais que a formação Ionizada do ácido, portanto, a forma molecular é lipossolúvel, então ela vai ser absorvida dessa forma, então, em Ph ácido absorve mais moléculas ácidas, ou sua forma molecular.
Após chegar no plasma, ele encontra outro Ph de 7,4, então as concentrações de ácido diminuiram e como consequência o equilíbrio é deslocado para forma iônica e altera-se a concentração, como consequência os íons não conseguem retornar e terão sua ação desencadeada.
Temos vários compartimentos e cada um deles tem um pH diferente podendo ter o fármaco na forma molecular ou iônica. Isso determina pq alguns fármacos agem melhor em alguns compartimentos que outros, isso justifica pq alguns fármacos atuam melhor na lágrima, outros no estômago, outros na região vaginal e assim por diante.
O gráfico abaixo, mostra o tipo de fármaco em relação a sua forma base ou ácido e seu pH, assim pode-se determinar em qual meio ele terá uma maior absorção.
Resumindo, se tivermos fármacos como as Penicilinas ou Aspirina que possuem um caráter ácido, serão melhor absorvidas no estômago. Se for uma base, terá sua absorção direcionada para o intestino, por exemplo.
O processo de absorção de um oral, dependendo da sua composição, segue o caminho abaixo. Neste caminho o fármaco é ingerido e chega até o suco gástrico dependendo do pH ou do pKa, caso não seja absorvido no estômago, ele irá se direcionar até o duodeno, porém o tempo de esvaziamento gástrico (tepo em que o estômago leva para que todo seu conteúdo seja levado até o duodeno), irá determinar o tempo que o fármaco irá levar para chegar até o duodeno. Essa absorção ocorre principalmente pela área de absorção é grande, mas também porque todo fármaco oral com absorção no duodeno irá cair na circulação porta, que é a corrente sanguínea q leva tudo que é absorvido pelo intestino até o fígado, e tudo que passar pelo fígado é transformado em metabólitos atívos, inativos ou substâncias hidrossolúveis.

O lado ruim é que ao passar por essa circulação, sua biodisponibilidade é reduzida. Então só depois que passa pelo fígado chega na circulação sistêmica e a´estará disponível para ligação aos locais de ação. A biodisponibilidade é o percentual da dose que chega ao sítio de ação.
Fatores que influenciam a absorção
Existem fatores e situações clínicas que influenciam a farmacocinética e biodisponibilidade referentes a quantidade do fármaco que será absorvido como o metabolismo hepático, disfunções hepáticas e insuficiência cardíaca congestiva. Além disso, existem outros fatores que podem alterar a biodisponibilidade e alterar sua ação, como mostra a tabela abaixo:
Pode-se notar que em relação a forma farmacêutica, por exemplo, formas líquidas são melhor absorvidas que sólida, ou seja, um medicamento tomado em gotas terá absorção mais rápida que o comprimido, que terá que passar pela fase biofarmacêutica onde a camada do comprimido é destruído, eliminado e dissolvido levando um tempo até ser quebrado o excipiente.
Áreas maiores, como o intestino, terão uma maior facilidade para absorção do fármaco. A circulação local também influencia, onde áreas com maior circulação, como intestino, irão apresentar maior absorção.
Além disso, outro fator é a condição patológica, onde áreas com inflamação facilitam a absorção pois a permeabilidade vascular é aumentada, já áreas inchadas, com edema, com líquido, dificultam a absorção.
Fatores que influenciam a velocidade de absorção
Existem fatores que alteram a velocidade de absorção e não a quantidade absorvida. Um desses fatores é o tempo de esvaziamento gástrico, ou seja, quanto tempo o estomago leva para abrir o seu esfincter para liberar o conteúdo gástrico para que ele chegue até o intestino, portanto, se esse tempo for menor, maior será a sua absorção e vice-versa. A motilidade intestinal também influencia, ou seja, quanto maior o tempo que ele ficar no intestino maior a absorção e se ficar pouco tempo no intestino irá ser mais demorada. Alimento é algo controverso porém a ausência de alimento normalmente ajudam e presença atrapalha porém existem casos onde isso não é verídico. Fatores de formulação também podem influenciar, onde a presença deles como edulcorantes e solubilizantes ajudam na absorção. O metabolismo entérico, que são metabolizados por células intestinais, influencia a velocidade também.
Interação com alimentos
Alguns fármacos podem alterar a sua absorção com uso ou não concomitante de alimentos. Fármacos muito lipossolúveis tem tendência a aumentar a absorção na presença de alimentos, que possuem também um conteúdo lipídico.
Vias de Administração de Medicamentos
Existem várias vias, mas a principal e comum e a via oral, porém temos as vias: sublingual, inalatória, parenteral (composta pela intramuscular, intravenosa e subcutânea), tópica, retal e transdermal.
Via Oral
Na via oral, a absorção intestinal tem uma desvantagem que é a passagem pelo figado, onde ao passar pelo fígado, há uma redução da biodisponibilidade pois parte da droga antes de chegar no seu local de ação ela sofre metabolismo. Existe também outra via que é oral também, que é a absorção sublingual, que é usada para a administração de hipertensivos e analgésicos como rivotril, nitrato, medicamentos para problemas cardíacos. As veias que se localizam abaixo da língua, elas levam o fármaco direto para o sangue sem que seja necessário passar pelo fígado.
As principais vantagens da via oral são a facilidade de administração, menos dispendiosa, porém são contra indicado para pessoas que estão envolvidas com náuseas e vômitos uma vez que ela pode eliminar o fármaco e dificuldades de deglutição e problemas no trato gastro intestinal.
Via Retal
A via retal é utilizada para supositórios, lavagem, clíster ou enema e apresenta a vantagem da proteção aos fármacos susceptíveis a inativação gastrointestinal e hepática, pois somente 50% do fluxo venoso retal tem acesso à circulação porta.
A desvantagem é que a absorção pode ser incompleta, especialmente em pacientes com motilidade intestinal aumentada, podendo irritar a mucosa.
Também como indicação para estados de coma, inconsciência, náusea e vômitos. Alguns fármacos que apresentam este método são o diazepan, metronidazol, alguns anti-inflamatórios e antieméticos.
Via Parenteral
Suas principais vias são a Intradérmica (ID), Subcutânea (SC), intramuscular (IM) e Intravenosa ou Endovenosa (IV ou EV). Possuem também outras vias secundárias como intra-arterial, intracardíaca (adrenalina), intra-araquídea, intraperitonial, intra-óssea, intra-articular e intrassinovial.
Via Intradérmica é uma forma de administração parenteral, bastante restritiva para pequenos volumes de 0,1 a 0,5ml. Usada para reações de hipersensibilidade para provas de ppd e sensibilidade de algumas alergias, fazer dessensibilização e vacinas como BCG.
A via subcutânea, é uma região um pouco mais profunda, na hipoderme. A absorção vai ocorrer pelas vias capilares de forma lenta e administrada para vacinar como anti-rábica, anticoagulantes e hipoglicemiantes como a insulina. O volume máximo é de 3ml.
A via intramuscular é a via mais utilizada pela rapidez na absorção pelo músculo ser bastante irrigado, o músculo deve ser bem desenvolvido, não possuir vasos de grande calibre. O volume injetado pode ser de 2 a 3ml na região deltoide, 4 a 5ml na região glútea e 3 a 4ml no músculo da coxa.
A via endovenosa é usada para introdução de mediação diretamente na veia por isso,requer mais cuidado. A aplicação é feita em membros superiores evitando articulações tendo como melhor local a face anterior do antebraço esquerdo. Sua indicação é para necessidade de ação imediata do medicamento, necessidade de injetar grandes volumes (hidratação) e introdução de substâncias irritantes aos outros tecidos.
A via tópica ou intradérmica é aplicada diretamente na pele ou na área ferida, com efeito local e tem por exemplos as pomadas, cremes, sprays, pastilhas para garganta, etc.
A via inalatória tem como área as fossas nasais até os bronquios, geralmente são partículas liquidas geradas por nebulizador ou vaporizador. Na aplicação na garganta através de spray deve-se evitar engolir saliva por 1 ou 2 minutos e beber agua após 30min.
Relação Via X Tempo de Absorção